1.
 可转化成有机物实现碳循环。在体积为2 L的恒容绝热(与外界没有热交换)密闭容器中,充入2 mol
可转化成有机物实现碳循环。在体积为2 L的恒容绝热(与外界没有热交换)密闭容器中,充入2 mol  和5 mol
和5 mol  , 一定条件下发生反应:
, 一定条件下发生反应: , 此反应为放热反应,测得
, 此反应为放热反应,测得 的物质的量随时间变化如图1所示。
的物质的量随时间变化如图1所示。
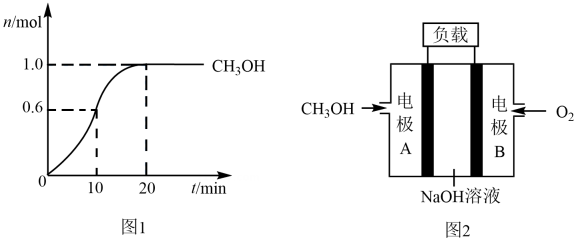
(1)
0~10 min内, 的平均反应速率
的平均反应速率
 , 第20 min时,
, 第20 min时, 的浓度
的浓度
 。
(2)
0~10 min内的平均反应速率(填“>”、“<”或“=”)10~20 min内的平均反应速率,可能的原因是(填标号)。
(3)
下列能说明上述反应达到平衡状态的是(填标号)。
(4)
CO与
。
(2)
0~10 min内的平均反应速率(填“>”、“<”或“=”)10~20 min内的平均反应速率,可能的原因是(填标号)。
(3)
下列能说明上述反应达到平衡状态的是(填标号)。
(4)
CO与 反应可制备
反应可制备 ,
,  可作为燃料使用,用
可作为燃料使用,用 和
和 组成的碱性燃料电池的结构示意图如图2,电池总反应为
组成的碱性燃料电池的结构示意图如图2,电池总反应为 , 则该燃料电池的正极为电极(填“A”或“B”),负极的电极反应式为。
, 则该燃料电池的正极为电极(填“A”或“B”),负极的电极反应式为。
a.0~10 min内,反应物浓度更大
b.0~10 min内,容器内温度较低
c.0~10 min内,生成物浓度更大
a.容器内温度不随时间的变化而变化
b.混合气体中各成分浓度之比为
c.单位时间内消耗a mol , 同时生成a mol
d.混合气体的平均相对分子质量不随时间的变化而变化
CH,
【考点】
电极反应和电池反应方程式;
化学电源新型电池;
化学反应速率;
化学反应速率的影响因素;
化学平衡状态的判断;
原电池工作原理及应用;
能力提升





