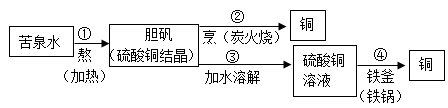
1.
如图甲所示,小乐向盛有一定量CuSO4溶液的烧杯中滴入过量的Na2CO3溶液,发现烧杯底部有蓝色固体生成。小乐对蓝色固体的成分进行了如下探究;
[建立猜想]①固体为CuCO3;②固体为Cu(OH)2;③固体为Cu(OH)2和CuCO3的混合物。
[设计实验]已知:Cu(OH)2、CuCO3受热易分解[Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃﹣220℃],各生成对应的两种氧化物。
步骤1:将烧杯中的混合物进行过滤,并对蓝色固体进行洗涤、低温烘干;
步骤2:取一定量的蓝色固体,用如图乙所示装置和药品,定性分析其成分;
步骤3:另取一定量的蓝色固体,用热分析仪对其进行热分解,定量测定其成分。

(1)
判断蓝色固体已洗净的方法及现象:。
(2)
若通过定性实验验证了猜想③正确,则观察到的实验现象是 。
(3)
通过热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图丙所示,可以计算得到Cu(OH)2的质量为 g。
【考点】
复分解反应及其应用;
能力提升
真题演练