1.
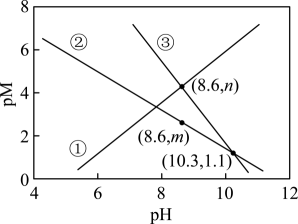
一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
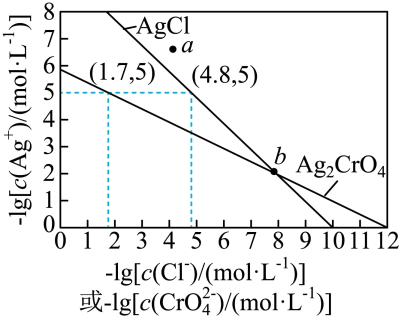
下列说法正确的是
A.
a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.
b点时,c(Cl-)=c(CrO ),Ksp(AgCl)=Ksp(Ag2CrO4)
C.
Ag2CrO4+2Cl-
),Ksp(AgCl)=Ksp(Ag2CrO4)
C.
Ag2CrO4+2Cl- 2AgCl+CrO
2AgCl+CrO 的平衡常数K=107.9
D.
向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
的平衡常数K=107.9
D.
向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
【考点】
难溶电解质的溶解平衡及沉淀转化的本质;
基础巩固
能力提升
变式训练
拓展培优
真题演练