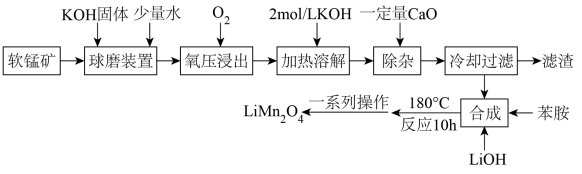
1.
锗是现化高科技产业重要的基础材料。用含氧化锌烟尘(杂质主要有 、
、 、
、 、
、 、
、 等)为主要原料制备氧化锌和高纯度单质锗的一种工艺流程如图所示。
等)为主要原料制备氧化锌和高纯度单质锗的一种工艺流程如图所示。

已知:①单宁酸是一种只含C、H、O元素的有机化合物
② , 常温下
,
,
,
③当溶液中某离子的物质的量浓度不大于时,该离子沉淀完全
(1)
“酸浸”后所得的滤渣主要成分除 外,还含有。(填化学式)
(2)
如图所示,“酸浸”过程中浓硫酸用量超过理论量会导致锗的浸出率降低,其可能的原因为。
(3)
“调
外,还含有。(填化学式)
(2)
如图所示,“酸浸”过程中浓硫酸用量超过理论量会导致锗的浸出率降低,其可能的原因为。
(3)
“调 ”所用试剂X为(填一种物质的化学式),若“酸浸”后溶液中
”所用试剂X为(填一种物质的化学式),若“酸浸”后溶液中 , 则应调控
, 则应调控 的范围为。
(4)
若“沉锌”的产物为
的范围为。
(4)
若“沉锌”的产物为 , 则反应的离子方程式为。
(5)
“水解”反应的化学方程式为。
(6)
在750℃的
, 则反应的离子方程式为。
(5)
“水解”反应的化学方程式为。
(6)
在750℃的 熔融盐体系中,将“水解”产物
熔融盐体系中,将“水解”产物 作为电极进行电解生成单质
作为电极进行电解生成单质 , 该电极反应式为。
, 该电极反应式为。

【考点】
物质的分离与提纯;
能力提升
真题演练