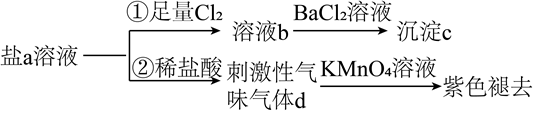
1.
SO2是大气污染物,SO2废气的处理可以先用H2还原成H2S后再设法回收S,主要涉及反应:3H2+SO2 H2S+2H2O。完成下列填空:
H2S+2H2O。完成下列填空:
(1)
写出硫化氢的电子式,硫原子的核外有种不同运动状态的电子。
(2)
列举一个硫元素比氧元素非金属性弱的事实:。
(3)
在一定温度下,向2L反应器中通入含SO2的废气与H2 , 经过10min,有0.4mol水生成,则这段时间内v(SO2)=。
(4)
一定条件下SO2与H2的反应达到平衡时,SO2的平衡转化率随温度(t)、压强(P)的变化如下图所示:
(5)
写出该方法吸收SO2的化学方程式。
(6)
所得的NaHSO3溶液呈酸性,运用相关化学用语进行解释。
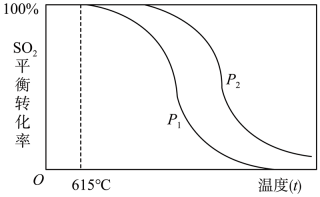
①根据上述信息可以判断:P1P2(填“>”、“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K将(填“变大”、“变小”或“不变”)。
③SO2废气的另一种处理方法是用Na2SO3溶液吸收,得到NaHSO3溶液。
【考点】
含硫物质的性质及综合应用;
能力提升
真题演练