1.
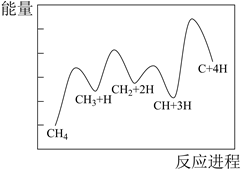
甲醇水蒸气重整制氢已经成为工业上制取氢气的重要工艺,甲醇水蒸气重整过程中可能出现以下反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)

 , 反应Ⅲ可在(填“高温”或“低温”或“任意温度”)下可自发进行。
(2)
一定温度下,将1mol甲醇与3mol水蒸气投入密闭容器中发生反应,一段时间后达到平衡,测得甲醇的转化率为80%,水蒸气体积分数为
, 反应Ⅲ可在(填“高温”或“低温”或“任意温度”)下可自发进行。
(2)
一定温度下,将1mol甲醇与3mol水蒸气投入密闭容器中发生反应,一段时间后达到平衡,测得甲醇的转化率为80%,水蒸气体积分数为 , 则
(3)
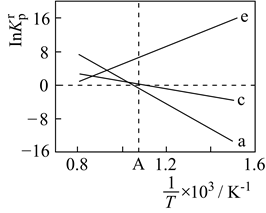
某科研团队对光催化还原
, 则
(3)
某科研团队对光催化还原 转化为甲醇进行研究(原理如图),取得了一定进展。
转化为甲醇进行研究(原理如图),取得了一定进展。
①该反应中水蒸气的转化率为。
②反应Ⅰ的压强平衡常数。
③若对体系增大压强,反应Ⅰ平衡(填“移动”或“不移动”)。

①电极1的电势(填“高于”或“低于”)电极2的电势。
②该光催化过程的总反应方程式为。
【考点】
盖斯定律及其应用;
化学反应速率与化学平衡的综合应用;
能力提升
真题演练