1.
乙烯的产量是衡量一个国家石油化工发展水平的重要标志。羟基氮化硼可高效催化乙烷氧化脱氢制乙烯。
主反应:
副反应:
(1)
 的燃烧热
的燃烧热 ,
,  的燃烧热
的燃烧热 ,
,  , 则
, 则 。
(2)
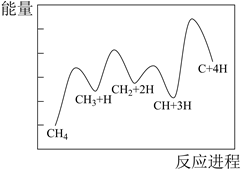
主反应的部分反应历程如下图所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能
。
(2)
主反应的部分反应历程如下图所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能
 。
(3)
提高乙烯平衡产率的方法是(任写两条),提高乙烯单位时间产量的关键因素是。
(4)
工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的
。
(3)
提高乙烯平衡产率的方法是(任写两条),提高乙烯单位时间产量的关键因素是。
(4)
工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的 、
、 和
和 混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
(5)
一定温度下,维持压强为
混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
(5)
一定温度下,维持压强为 , 向反应装置中通入
, 向反应装置中通入 和
和
 的混合气体,经过
的混合气体,经过 后,反应达到平衡,此时乙烷的转化率为
后,反应达到平衡,此时乙烷的转化率为 , 乙烯选择性为
, 乙烯选择性为 (
( )。反应速率
)。反应速率
 , 该温度下反应
, 该温度下反应 的平衡常数
的平衡常数
 。
。


①曲线Ⅰ中,a点右侧乙烯产量随温度升高而降低的原因是。
②两种催化剂比较,催化剂Ⅱ的优点与不足是。
【考点】
盖斯定律及其应用;
化学反应速率与化学平衡的综合应用;
能力提升
真题演练