1.
甲酸 又名蚁酸,是一种常见的弱酸,常温下甲酸的电离平衡常数
又名蚁酸,是一种常见的弱酸,常温下甲酸的电离平衡常数 (已知
(已知 )。
)。
(1)
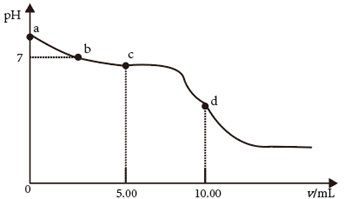
设计实验证明甲酸为弱酸,下列实验设计合理的是____(填选项字母)。
A.
将甲酸溶液滴入 溶液中,观察是否有气泡生成
B.
向体积相同、
溶液中,观察是否有气泡生成
B.
向体积相同、 相同的盐酸和甲酸溶液中加入足量
相同的盐酸和甲酸溶液中加入足量 , 比较溶解
, 比较溶解 的质量
C.
取一定浓度的甲酸钠溶液,测其
的质量
C.
取一定浓度的甲酸钠溶液,测其 (2)
(2)
 的甲酸钠
的甲酸钠 溶液和
溶液和 的甲酸溶液等体积混合可配成一种缓冲溶液。
(3)
催化甲酸分解的一种反应机理和相对能量的变化情况如图所示。
的甲酸溶液等体积混合可配成一种缓冲溶液。
(3)
催化甲酸分解的一种反应机理和相对能量的变化情况如图所示。
①的水解平衡常数
。
②该混合溶液的约为。
③该混合溶液中(填“>”“=”或“<”)
。

①已知催化剂“I”带一个正电荷,反应过程中的中间产物也带一个正电荷的是(填“II”“III”或“IV”)。
②由反应进程可知甲酸分解的(填“>”“=”或“<”)0,该历程中的决速步骤为(填选项字母),历程中最大能垒(活化能)
。
a.I转化为II的过程 b.II转化为III的过程
c.III转化为IV的过程 d.IV转化为I的过程
【考点】
弱电解质在水溶液中的电离平衡;
盐类水解的原理;
能力提升
真题演练