1.
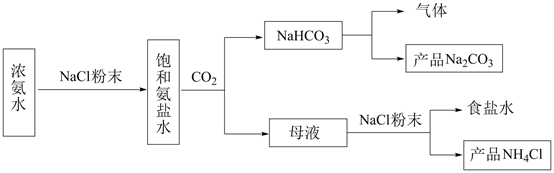
我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。联合制碱法的工艺流程简化如下:

(1)
I.资料1:反应I中的化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓
(2)
相同温度下,用pH试纸测量同等浓度的Na2CO3与NaHCO3溶液pH,溶液碱性强。
(3)
离子反应: , BaSO4难溶生成沉淀,符合复分解反应发生的条件;反应I中NaHCO3不是难溶物,也生成了沉淀,理由是。
(4)
II.泡腾片是一种医药片剂,适用于儿童、老年人以及吞服药丸困难的患者。泡腾片放入水中,在崩解剂的作用下,即刻产生大量气泡(二氧化碳),使片剂迅速崩解形成水溶液,崩解剂主要由NaHCO3固体与柠檬酸固体组成。
(5)
某NaHCO3样品中含NaCl杂质,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中NaHCO3的质量分数是。
, BaSO4难溶生成沉淀,符合复分解反应发生的条件;反应I中NaHCO3不是难溶物,也生成了沉淀,理由是。
(4)
II.泡腾片是一种医药片剂,适用于儿童、老年人以及吞服药丸困难的患者。泡腾片放入水中,在崩解剂的作用下,即刻产生大量气泡(二氧化碳),使片剂迅速崩解形成水溶液,崩解剂主要由NaHCO3固体与柠檬酸固体组成。
(5)
某NaHCO3样品中含NaCl杂质,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中NaHCO3的质量分数是。
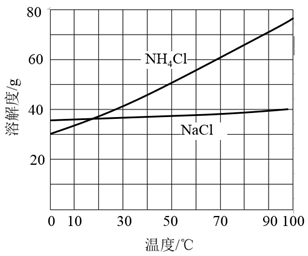
资料2:20℃时,溶解度小于0.0lg的物质属于难溶物;20℃时BaSO4溶解度为g。
资料3:表1有关物质的溶解度(20℃)
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
操作I的名称为 ,反应II的化学方程式为。
下列说法正确的是____(填字母)。
A. NaHCO3固体与柠檬酸固体不反应 B. 柠檬酸在水中电离产生H+与NaHCO3反应 C. Na2CO3比NaHCO3稳定,受热不易分解【考点】
纯碱工业(侯氏制碱法);
能力提升
真题演练



 已知:25℃时,
已知:25℃时, 
 B.
B. 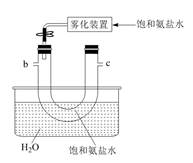 C.
C.  D.
D. 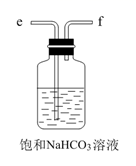 E.
E.