1.
运用化学反应原理研究氮及其化合物的反应有重要意义。
(1)
写出NH3的电子式,NH3催化氧化的化学方程式为。
(2)
合成氨反应N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ·mol-1 , 在工业生产中温度常控制在480℃,而非常温。请从化学反应速率和催化剂的角度加以解释。
(3)
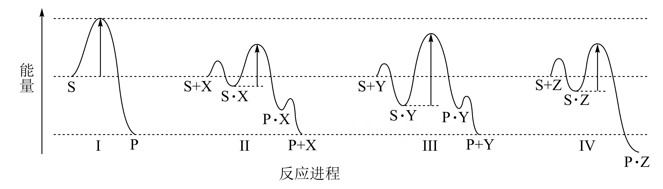
合成氨过程中发生的反应机理如下:
2NH3(g)△H=-92.4kJ·mol-1 , 在工业生产中温度常控制在480℃,而非常温。请从化学反应速率和催化剂的角度加以解释。
(3)
合成氨过程中发生的反应机理如下:
I.2xFe+N22FexN(慢);
II.2FexN+3H2(g)2xFe+2NH3(g)(快)
回答下列问题:
合成氨反应的速率快慢主要取决于(填“I”或“II”)。
②合成氨反应的催化剂是(填化学式)。
③反应I的活化能反应II的活化能(填“>”“=”或“<”)。
④使用催化剂前后,合成氮反应的△H(填“增大”“减小”或“不变”)。
【考点】
活化能及其对化学反应速率的影响;
真题演练