1.
我国力争在2030年前实现碳达峰,降低碳排放的一个重要措施是 的综合利用,如工业利用
的综合利用,如工业利用 合成
合成 , 再合成
, 再合成 。
。
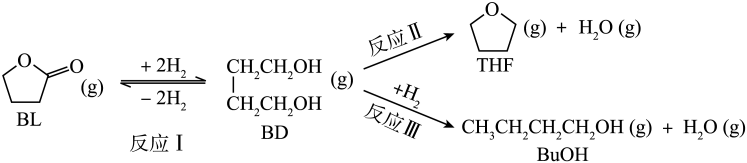
I.(主反应)
II.(副反应)
请回答:
(1)
工业原料气配比中需加入一定量的CO,原因是。
(2)
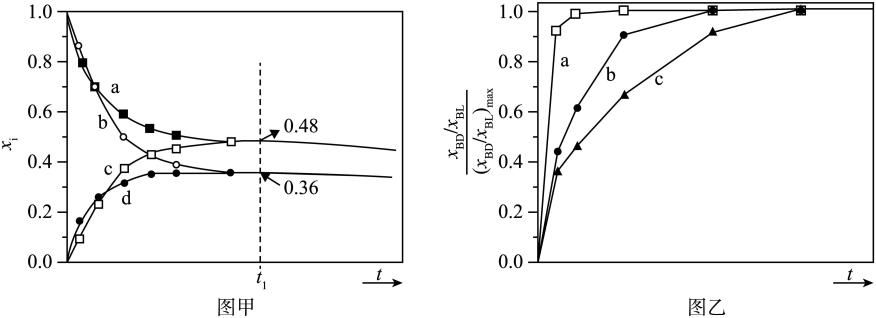
在温度为T,恒压P的条件下,充入 的
的 和
和 此时体积为2升,发生I、Ⅱ反应达平衡时
此时体积为2升,发生I、Ⅱ反应达平衡时 的物质的量为
的物质的量为 ,
,  的物质的量分数为
的物质的量分数为 , 求:(保留2位小数)
(3)
二甲醚在有机化工中有重要的应用,可以利用上述合成的甲醇制备二甲醚
(4)
研究表明,在催化剂
, 求:(保留2位小数)
(3)
二甲醚在有机化工中有重要的应用,可以利用上述合成的甲醇制备二甲醚
(4)
研究表明,在催化剂 的催化下,
的催化下, 与
与 合成
合成 , 主要催化过程如下(H*表示活性氢原子)
, 主要催化过程如下(H*表示活性氢原子)
①的转化率。
②反应I的平衡常数K为。
III.(主反应)
IV.(副反应)
在一定条件下发生反应的能量关系如图所示

①当反应一定时间,测得副产品的含量特别高,分析原因。
②为提高反应Ⅲ生成的选择性(转化的
中生成二甲醚的百分比),下列措施中合适的是。
A.适当增大压强 B.升高温度
C.使用合适催化剂 D.未达平衡时及时分离产品

则A、B结构是、。
【考点】
化学平衡的影响因素;
化学平衡的计算;
能力提升
真题演练