1.
硫、氮、氯、氧、钠、铝、铁等是人们熟悉的元素,它们的单质及其化合物对工农业有着很重要的地位。
(1)
硫原子的最外层电子排布式。铝原子核外电子占据轨道有个,氯原子能量最高的电子亚层是。过氧化钠的电子式;氮原子的电子云形状有种。
(2)
氯化钠晶体的熔点高于氯化钾,原因是。
(3)
用Fe2(SO4)3溶液吸收H2S生成FeSO4。FeSO4被氧化使Fe2(SO4)3再生,其原理为: FeSO4+O2+H2SO4 Fe2(SO4)3+H2O
(4)
常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
Fe2(SO4)3+H2O
(4)
常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
①配平上面Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向。
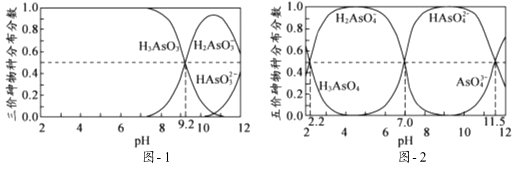
②硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为;若反应温度过高,反应速率下降,其原因是。

温度(℃) | c(氨水)(mol/L) | 电离度(%) | c(OH-)(mol/L) |
0 | 16.56 | 9.098 | 1.507×10-2 |
10 | 15.16 | 10.18 | 1.543×10-2 |
20 | 13.63 | 11.2 | 1.527×10-2 |
①温度升高,NH3·H2O的电离平衡向(填“左”、“右”)移动。
②表中c(OH-)基本不变的原因是。
【考点】
弱电解质在水溶液中的电离平衡;
能力提升
真题演练