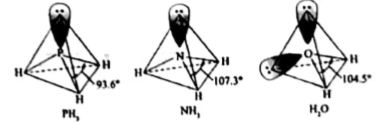
1.
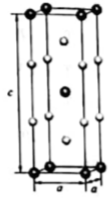
研究笼形包合物结构和性质具有重要意义。化学式为 的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为
的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为 。回答下列问题:
。回答下列问题:
(1)
基态 原子的价电子排布式为,在元素周期表中位置为。
(2)
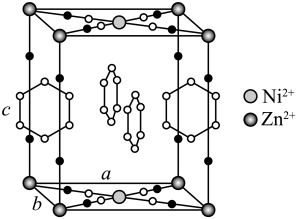
晶胞中N原子均参与形成配位键,
原子的价电子排布式为,在元素周期表中位置为。
(2)
晶胞中N原子均参与形成配位键, 与
与 的配位数之比为;
的配位数之比为; ;晶胞中有d轨道参与杂化的金属离子是。
(3)
吡啶(
;晶胞中有d轨道参与杂化的金属离子是。
(3)
吡啶(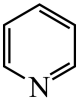 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的 大
大 键、则吡啶中N原子的价层孤电子对占据____(填标号)。
A.
2s轨道
B.
2p轨道
C.
sp杂化轨道
D.
sp2杂化轨道
(4)
在水中的溶解度,吡啶远大于苯,主要原因是①,②。
(5)
键、则吡啶中N原子的价层孤电子对占据____(填标号)。
A.
2s轨道
B.
2p轨道
C.
sp杂化轨道
D.
sp2杂化轨道
(4)
在水中的溶解度,吡啶远大于苯,主要原因是①,②。
(5)
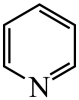 、
、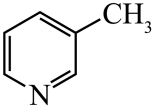 、
、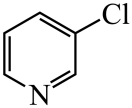 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的 、
、 、
、 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
【考点】
原子核外电子排布;
晶胞的计算;
原子轨道杂化方式及杂化类型判断;
氢键的存在对物质性质的影响;