1.
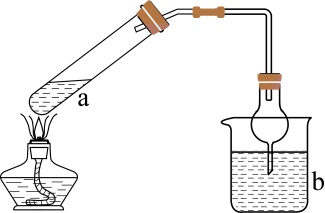
离子化合物甲由两种短周期元素组成,其式量为83,所含金属阳离子焰色试验为黄色。为探究该化合物的水解产物,设计了如图实验:

回答下列问题:
(1)
检验装置A气密性良好的方法,实验中观察到B中的试纸变为蓝色,则化合物甲的化学式为。
(2)
装置C的作用为,F中盛有稀硫酸和四氯化碳,四氯化碳的作用为,F装置中发生化学反应的方程式为。
(3)
实验结束后装置D得到紫红色固体,E中无水硫酸铜变蓝,F中有无色无味气体逸出,写出D中发生反应的化学方程式。
【考点】
物质检验实验方案的设计;
化学实验方案的评价;
能力提升
真题演练