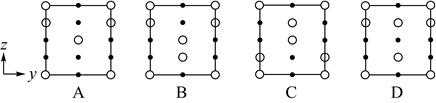
1.
原子结构与元素周期表存在着内在联系。根据已学知识,请你回答下列问题:
(1)
指出31号元素镓( Ga)在元素周期表中的位置:第周期第族。
(2)
X原子在第二电子层上只有一个空轨道,则X的轨道表示式为。
(3)
被誉为“21世纪的金属"的钛(Ti)元素原子的价电子排布式为。
(4)
写出原子序数最小的第ⅠB族元素原子的核外电子排布式: 。
(5)
日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素原子的价电子排布式为3d54s1 , 该元素的名称为 。
【考点】
原子核外电子排布;
原子核外电子的能级分布;
能力提升
真题演练


 )形式存在的原因是。
)形式存在的原因是。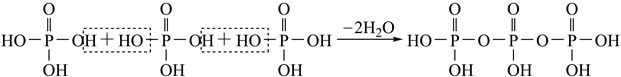 如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。