1.
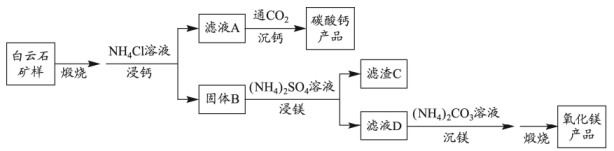
实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

(1)
“滤液”中的主要阳离子为(填化学式)。
(2)
“除杂”分为两步:先除去PbCl2 , 再除去Ag2S。
(3)
室温下,可逆反应AgCl+2NH3·H2O⇌[Ag(NH3)2]++Cl-+2H2O的平衡常数K=。{Ksp(AgCl)= 1.8×10-10 , Ag++2NH3·H2O⇌[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)
“还原”过程中发生反应的离子方程式为 。
(5)
粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:,过滤,,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaCl2溶液)
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是。
【考点】
难溶电解质的溶解平衡及沉淀转化的本质;
能力提升
真题演练