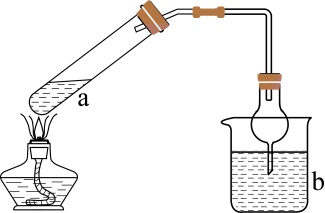
1.
下列有关实验叙述正确的是
A 为了减缓电石和水的反应速率,可用饱和食盐水来代替水进行实验.
B 银氨溶液配制方法:将硝酸银溶液滴到氨水溶液中,至产生的白色沉淀恰好消失.
C 浓溴水滴入苯酚溶液中立即产生2,4,6﹣三溴苯酚的白色沉淀.
D 将l0滴溴乙烷加入 1mL 10%的烧碱溶液中加热片刻后,先加入稀盐酸酸化,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
E 只用水就能鉴别苯、硝基苯、乙醇
F 实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃.
【考点】
化学实验方案的评价;
能力提升
变式训练
拓展培优
真题演练


 +_______KMnO4
+_______KMnO4





 C.
C.