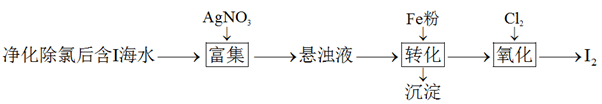
1.
某厂废水中含KCN,其浓度为0.01mol•L﹣1 , 现用氯氧化法处理,发生如下反应(化合物中N化合价均为﹣3价):
(1)
KCN+2KOH+Cl2═KOCN+2KCl+H2O被氧化的元素是.(用元素符号表示)
(2)
投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
(3)
若将10L含KCN的浓度为0.01mol•L﹣1的废水中KCN氧化除去,最少需要氯气 mol.
(4)
某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定.现实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需
(5)
Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42﹣ , 因此Na2S2O3常用作脱氯剂,该反应的离子方程式为.
(6)
现取(3)中溶液20.00mL,用amol•L﹣1 Na2S2O3溶液进行滴定,经过平行实验测得消耗Na2S2O3标准溶液b mL,计算废液中Cl2的浓度为 mol•L﹣1 (用含a、b的表达式表示).
KOCN+Cl2+═ K2CO3+N2+KCl+.
【考点】
氧化还原反应方程式的配平;
能力提升
真题演练