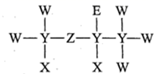1.
下列有关物质性质的比较顺序中,不正确的是( )
A.
热稳定性:HF<HCl<HBr<HI
B.
微粒半径:K+>Na+>Mg2+>Al3+
C.
酸性:HClO4>H2SO4>H3PO4>H2SiO3
D.
熔点:Li<Na<K<Rb
【考点】
元素周期表中原子结构与元素性质的递变规律;
基础巩固
能力提升
变式训练
拓展培优
真题演练