1.
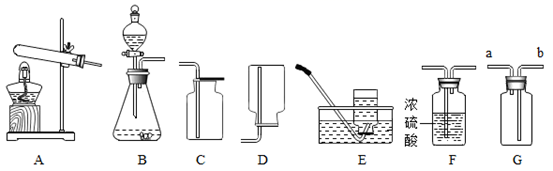
某化学兴趣小组设计了一组“吹气球”实验,三套装置如图:

(1)
甲装置:
(2)
乙装置:若生成O2使气球胀大,则锥形瓶中所装的固体物质可以是.
(3)
丙装置:若锥形瓶中盛满CO2 , 欲使气球胀大,则分液漏斗中的液体可以是。
①仪器a的名称为
②向a中加水会看到气球胀大,一段时间内气球大小没有变化,说明该装置气密性.
【考点】
氧气的实验室制法;
能力提升
真题演练