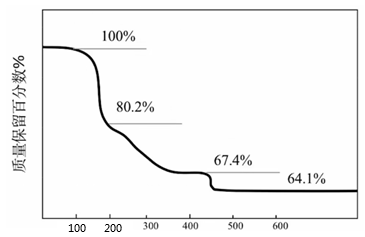
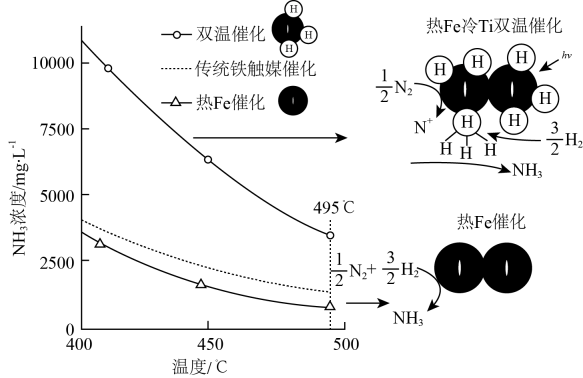
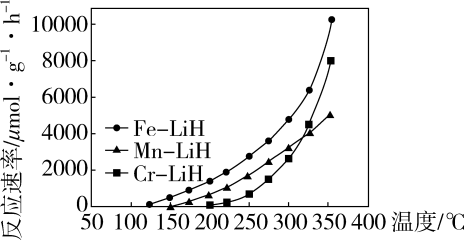
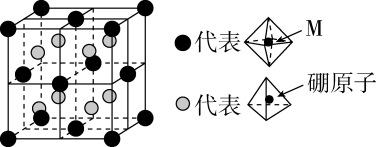
1.
根据下列叙述,写出元素名称及核外电子排布式。
(1)
A元素原子核外M层电子数是L层电子数的一半:。
(2)
B元素原子的最外层电子数是次外层电子数的1.5倍:。
(3)
C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃:。
(4)
D元素原子的次外层电子数是最外层电子数的:。
【考点】
原子核外电子排布;
能力提升
真题演练