1.
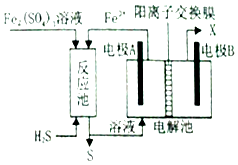
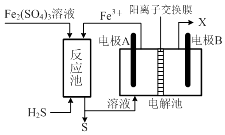
水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)
Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
(2)
721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.
<0.25
B.
0.25
C.
0.25~0.50
D.
0.50
E.
>0.50
(3)
我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用  标注。
(4)
Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
标注。
(4)
Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是COH2(填“大于”或“小于”)。

可知水煤气变换的ΔH0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=eV,写出该步骤的化学方程式。

计算曲线a的反应在30~90 min内的平均速率 (a)=kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是、。489 ℃时PH2和PCO随时间变化关系的曲线分别是、。
【考点】
氧化性、还原性强弱的比较;
反应热和焓变;
化学反应速率;
化学平衡的计算;
能力提升