1.
学会识图能发展科学思维。下列图像与反应过程的变化趋势对应正确的有
序号 | ① | ② | ③ | ④ |
图 像 |
|
|
|
|
反 应 过 程 | 等质量,等质量分数的稀盐酸和氢氧化钠溶液混合 | 向一定量NaOH溶液中逐滴加入pH=2的稀盐酸至过量 | 将过量的铁粉加入硝酸银和硝酸铜的混合溶液中 | 将氢氧化钡固体加入到一定质量的硫酸溶液中 |
A.
1个
B.
2个
C.
3个
D.
4个
【考点】
金属的化学性质;
碱的化学性质;
中和反应及其应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练








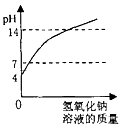 向pH=4的盐酸溶液中不断加入氢氧化钠溶液
向pH=4的盐酸溶液中不断加入氢氧化钠溶液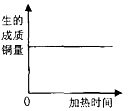 在密闭容器中加热木炭和氧化铜粉末的混合物
在密闭容器中加热木炭和氧化铜粉末的混合物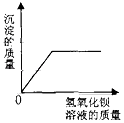 向一定量的盐酸和硫酸钠的混合溶液中加入氢氧化钡溶液
向一定量的盐酸和硫酸钠的混合溶液中加入氢氧化钡溶液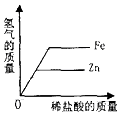 向等质量的锌粉和铁粉中分别加入溶质质量分数相同且足量的稀盐酸
向等质量的锌粉和铁粉中分别加入溶质质量分数相同且足量的稀盐酸 向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液
向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 用等质量、等溶液的过氧化氢溶液在有无催化剂条件下制氧气
用等质量、等溶液的过氧化氢溶液在有无催化剂条件下制氧气 一定质量稀盐酸中逐滴加入氢氧化钠溶液
一定质量稀盐酸中逐滴加入氢氧化钠溶液