1.
铁是生产生活中使用最广泛的金属,但铁制品容易腐蚀生锈。
探究一:铁制品锈蚀的条件
步骤1:利用图一所示装置,将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,将导管a、b处的止水夹K1、K2夹紧。
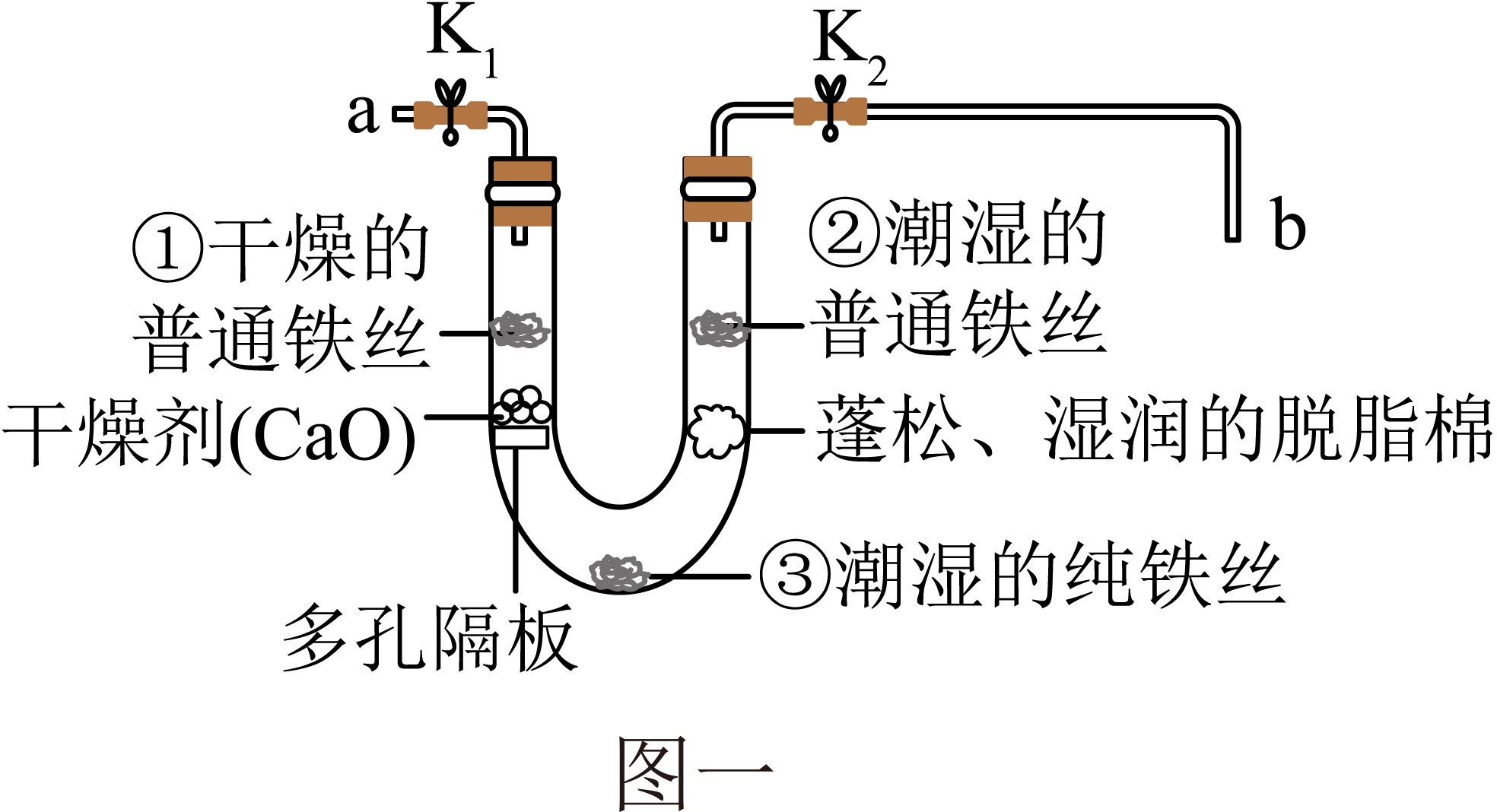
步骤2:一段时间后,观察U形管内三处铁丝表面的变化情况。
回答下列问题:
(1)
步骤1中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有(填化学式),②处可能观察到的现象是,③处没有明显变化,说明纯铁的抗腐蚀能力较(填“强”或“弱”)。
(2)
待U形管内有明显现象后,将b导管插入水中,打开止水夹K2 , 观察到现象,说明该条件下铁制品锈蚀过程消耗了O2。
(3)
探究二:酸性条件下铁发生腐蚀的影响因素
(4)
编号①实验测得容器中压强随时间变化如图三,t2时容器中压强明显小于起始压强,其原因是。
(5)
兴趣小组总结了图四中0~t1时压强增大的原因,可能是。
将混合均匀的铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图二)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
编号 | 实验目的 | 炭粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验做参照 | 1.0 | 3.0 | 80.0 |
② | 探究醋酸浓度的影响 | 1.0 | 32.0 | |
③ | 0.5 | 3.0 | 80.0 |

资料:炭粉不参与锥形瓶中的化学反应,醋酸溶液显酸性。
上表中编号②实验中铁粉的质量为;编号③实验的实验目的是。
【考点】
探究金属锈蚀的条件;
能力提升
真题演练








 甲:头发被带电的气球吸引,说明头发原来一定带电
甲:头发被带电的气球吸引,说明头发原来一定带电 乙:两个铅柱没有被重物拉开,说明分子之间存在引力
乙:两个铅柱没有被重物拉开,说明分子之间存在引力 丙:一段时间后,只有①中铁钉生锈,说明铁生锈与水有关
丙:一段时间后,只有①中铁钉生锈,说明铁生锈与水有关 丁:干冷的烧杯内壁有水珠生成,说明蜡烛中含有氢元素
丁:干冷的烧杯内壁有水珠生成,说明蜡烛中含有氢元素