1.
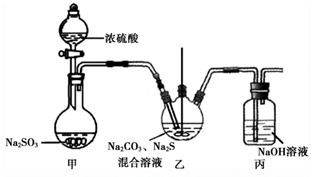
氯化亚砜(SOCl2)常用作脱水剂。某校科研小组拟以Cl2、S2Cl2、ClSO3H(氯磺酸)为原料合成SOCl2并探究其相关性质,制备装置如图所示。有关物质的部分性质见表。
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SOCl2 | -105 | 78.8 | 易水解,温度高于150℃分解 |
ClSO3H | -80 | 156 | 具有强吸水性,不易分解 |
S2Cl2 | -77 | 138 | 遇水即反应 |

回答下列问题:
(1)
装置A中可能的试剂是(选填数字编号)。
(2)
装置D中盛放的试剂是,装置E的作用是。
(3)
将SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3 , 试解释原因。
(4)
小明同学认为SOCl2也可与FeCl3·6H2O混合制取无水FeCl3 , 但小强同学认为可能会发生副反应使最后的产品不纯,可能产生的杂质微粒是;为验证猜想,可选择的试剂是(选填数字编号)。
(5)
若硫元素全部转化到目标产物中,在50℃下C中发生反应的化学方程式为;反应结束后,利用如图所示装置将C中混合物分离,毛细玻璃管的作用是。
①MnO2和盐酸
②KMnO4和浓盐酸
③漂白粉和浓盐酸
④浓硫酸与NaCl
①BaCl2溶液、稀盐酸
②Ba(NO3)2溶液、稀HNO3
③KSCN溶液
④K3[Fe(CN)6]溶液

【考点】
含硫物质的性质及综合应用;
制备实验方案的设计;