1.
Na2S2O3应用广泛,水处理中常用作还原剂、冶金中常用作络合剂。
(1)
Na2S2O3的实验室制法:装置如图(加热和夹持装置略):
(2)
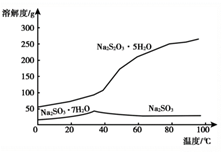
实际工业生产中制得的Na2S2O3溶液中常混有少量Na2SO3 , 结合溶解度曲线(如图),获得Na2S2O3•5H2O的方法是。
(3)
Na2S2O3的用途:氨性硫代硫酸盐加热浸金是一种环境友好的黄金(Au)浸取工艺。
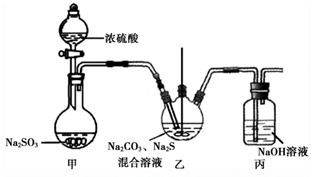
已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S = Na2S2O3
①甲中发生反应的化学方程式为。
②实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3。一段时间后,乙中再次出现少量浑浊,此时须立刻停止通入SO2。结合离子方程式解释此时必须立刻停止通入SO2的原因:。
③丙中,NaOH溶液吸收的气体可能有。
已知:I. Cu(NH3)42+=Cu2++4NH3;
II. Cu2+在碱性较强时受热会生成CuO沉淀。
①将金矿石浸泡在Na2S2O3、Cu(NH3)42+的混合溶液中,并通入O2。浸金反应的原理为:i.Cu(NH3)42+
+ Au + 2S2O32− Cu(NH3)2+ + Au(S2O3)23−+ 2NH3
ii.4Cu(NH3)2+ + 8NH3+ O2 + 2H2O = 4Cu(NH3)42+ + 4OH−
浸金过程Cu(NH3)42+起到催化剂的作用,金总反应的离子方程式为:。
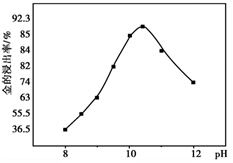
② 一定温度下,相同时间金的浸出率随体系pH变化曲线如如图,解释pH>10.5时,金的浸出率降低的可能原因。(写出2点即可)
【考点】
含硫物质的性质及综合应用;