1.
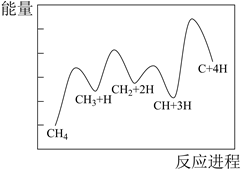
2021年6月17日神舟十三号载人飞船与空间站成功对接,航天员进入天和核心舱。空间站处理 的一种重要方法是
的一种重要方法是 的收集、浓缩与还原。
的收集、浓缩与还原。
(1)
 还原
还原 制
制 的部分反应如下:
(2)
在催化剂作用下
的部分反应如下:
(2)
在催化剂作用下 加氢可制得甲醇,该反应历程如下图所示(吸附在催化剂表面的物质用*标注,如
加氢可制得甲醇,该反应历程如下图所示(吸附在催化剂表面的物质用*标注,如 表示
表示 吸附在催化剂表面;图中
吸附在催化剂表面;图中 已省略)。
(3)
在一定条件下,向某
已省略)。
(3)
在一定条件下,向某 恒容密闭容器中充入
恒容密闭容器中充入 和
和 , 发生反应
, 发生反应 。
。
①
②
③
反应的
。

上述合成甲醇的反应速率较慢,该反应过程中决定反应速率的步骤是(用化学方程式表示)。

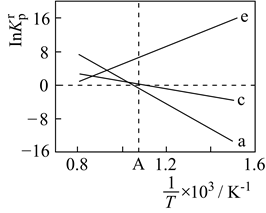
①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线 (填“m”或“n”),判断依据是。
②若 , 测得在相同时间内,不同温度下
的转化率如图2所示,
(填“>”、“<”或“=”);
时,起始压强为
(保留二位小数;
为以分压表示的平衡常数,分压=总压×物质的量分数)。
③已知速率方程是速率常数,只受温度影响。图3表示速率常数的对数
与温度的倒数
之间的关系,
分别代表图2中a点、c点的速率常数,点表示c点的
。
【考点】
盖斯定律及其应用;
化学反应速率与化学平衡的综合应用;
能力提升
真题演练