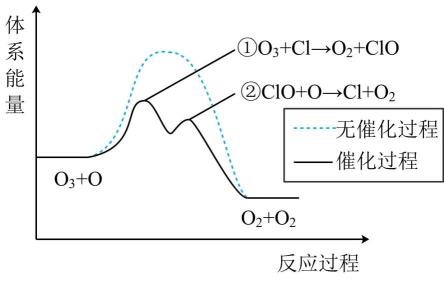
1.
 可用作有机合成的氯化剂。在体积为
可用作有机合成的氯化剂。在体积为 的密闭容器中充入
的密闭容器中充入 , 发生反应:
, 发生反应: , 图中所示曲线分别表示反应在
, 图中所示曲线分别表示反应在 时和平衡时
时和平衡时 的转化率
的转化率 与温度
与温度 的关系。下列说法正确的是 ( )
的关系。下列说法正确的是 ( )

A.
 的
的 B.
B.
 , 从
, 从 , 以
, 以 表示反应的平均速率为
表示反应的平均速率为 C.
当容器中混合气体的平均相对分子质量恒定不变时,反应达到平衡状态
D.
82℃,若起始时在该密闭容器中充入
C.
当容器中混合气体的平均相对分子质量恒定不变时,反应达到平衡状态
D.
82℃,若起始时在该密闭容器中充入 和
和 各
各 , 则此时v(逆)>v(正)
, 则此时v(逆)>v(正)
【考点】
吸热反应和放热反应;
化学反应速率与化学平衡的综合应用;
基础巩固
能力提升
变式训练
拓展培优