1.
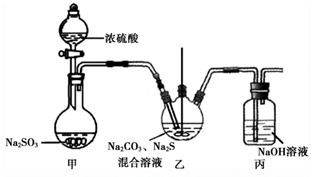
硫代硫酸钠(Na2S2O3)是常见的分析试剂,临床上用于氰化物解毒。实验室制备Na2S2O3溶液的装置如图(部分装置省略,C中Na2SO3过量):

完成下列填空:
(1)
Na2S2O3解毒氰化物原理:S2O +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN- , 取反应后的少量溶液,先加入足量的盐酸,再加入,观察到的现象是。
(2)
装置A制取SO2的反应,体现了70%浓硫酸的性,装置B的作用是。
(3)
装置C中的反应分两步。第二步反应为S+Na2SO3→Na2S2O3 , 写出第一步反应的化学方程式。当观察到装置C中溶液,说明反应已完全。
(4)
样品中Na2S2O3·5H2O(M=248g·mol-1)的含量可用K2Cr2O7标准溶液测定(杂质不参与反应),步骤如下:
(5)
样品中Na2S2O3·5H2O的质量分数为;若样品中含Na2SO3杂质,则所测Na2S2O3·5H2O的含量 (选填“偏高”或“偏低”)。
。为检验该转化生成了SCN- , 取反应后的少量溶液,先加入足量的盐酸,再加入,观察到的现象是。
(2)
装置A制取SO2的反应,体现了70%浓硫酸的性,装置B的作用是。
(3)
装置C中的反应分两步。第二步反应为S+Na2SO3→Na2S2O3 , 写出第一步反应的化学方程式。当观察到装置C中溶液,说明反应已完全。
(4)
样品中Na2S2O3·5H2O(M=248g·mol-1)的含量可用K2Cr2O7标准溶液测定(杂质不参与反应),步骤如下:
(5)
样品中Na2S2O3·5H2O的质量分数为;若样品中含Na2SO3杂质,则所测Na2S2O3·5H2O的含量 (选填“偏高”或“偏低”)。
①取0.0100mol·L-1的K2Cr2O7溶液20.00mL,用硫酸酸化后,加入过量KI;
②用0.400g样品配制的溶液滴定步骤①所得溶液至淡黄绿色,再加入淀粉溶液,继续滴定至终点时,恰好将样品溶液消耗完全。
步骤①、②中发生的反应分别为:Cr2O+6I-+14H+→2Cr3++3I2+7H2O,I2+2S2O
→2I-+S4O
。
判断步骤②的滴定终点。
【考点】
二氧化硫的性质;
含硫物质的性质及综合应用;
中和滴定;
能力提升