1.
羟胺(  )为无色固体,结构可视为
)为无色固体,结构可视为  替代
替代  中1个
中1个  ,羟胺具有和
,羟胺具有和  类似的弱碱性,可以与盐酸反应生成盐酸羟胺(
类似的弱碱性,可以与盐酸反应生成盐酸羟胺(  ),盐酸羟胺是一种盐,易溶于水,溶解后完全电离为
),盐酸羟胺是一种盐,易溶于水,溶解后完全电离为  和
和  。
。
(1)
 中
中  元素的化合价是。
(2)
过氧化氢催化氧化氨水法制备盐酸羟胺的原理如下:
(3)
电化学法制备盐酸羟胺:
元素的化合价是。
(2)
过氧化氢催化氧化氨水法制备盐酸羟胺的原理如下:
(3)
电化学法制备盐酸羟胺:
步骤1:  +NH3+H2O2
+NH3+H2O2 X+2H2O
步骤2:X+HCl+H2O⇌NH2OH HCl+

资料:丙酮(  )是一种易溶于水的无色液体,沸点为
)是一种易溶于水的无色液体,沸点为 。
① 的分子式为
,其核磁共振氢谱只有两个吸收峰,红外光谱显示其分子结构中存在羟基和碳氮双键。
的结构简式是。
②步骤1中,相同反应时间氨的转化率随温度变化如图1。温度高于 时,随温度上升氨的转化率变化的原因是。

③步骤2中,在密闭容器中反应时, 的平衡转化率随温度变化如图2。该反应为(填“吸热”或“放热”)反应。

④步骤2中蒸馏出丙酮的目的是(1点即可)。
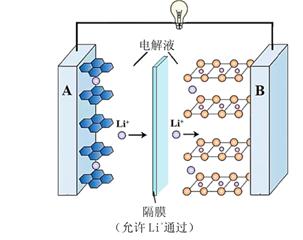
向两侧电极分别通入 和
,以盐酸为电解质,组装原电池以制备盐酸羟胺。装置(图3)和正极反应机理图(图4):
 ①将图4方框中缺失的物质补充完整。
①将图4方框中缺失的物质补充完整。
②一段时间后,正极区的 与反应前相比(填“增大”、“减小”或“不变”)(不考虑溶液体积的变化)。
【考点】
电极反应和电池反应方程式;
化学平衡移动原理;
利用质谱、红外光谱、核磁共振等确定有机物的结构;
制备实验方案的设计;
电解池工作原理及应用;
能力提升

 ①随着温度的升高,Li2CO3的产率逐渐减小的原因是。
①随着温度的升高,Li2CO3的产率逐渐减小的原因是。