1.
工业废水中含+6价的铬会损害环境,必须进行处理。某工厂的处理工艺流程如下:

(1)
N2H4的电子式为。
(2)
下列溶液中,可替代N2H4的是。(填选项序号字母)
(3)
已知加入N2H4后,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为。
(4)
在实际工业生产中,处理含铬废水还可采用直接沉淀的方法,其成本较低。
(5)
工业上还可用电解法来处理含Cr2O72-的酸性废水,通过电解制得还原剂。右图为电解装置示意图(电极材料分别为铁和石墨)。
a.FeSO4溶液
b.浓HNO3溶液
c.酸性KMnO4溶液
d.Na2SO3溶液
①已知酸性废水中存在Cr2O72-和CrO42-的转化平衡,请用离子方程式表示它们之间的转化反应;
②加入沉淀剂BaCl2溶液之前需加入一定量的NaOH溶液,以利于沉淀的生成,则生成的沉淀为(写化学式)。
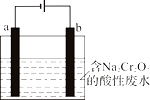
①装置中b电极的材料是(填“铁”或“石墨”)。
②该处理过程中,Cr2O72-被还原成Cr3+的离子方程式为。
【考点】
氧化还原反应;
氧化还原反应方程式的配平;
能力提升
真题演练

