1.
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应,浓硫酸可吸收水蒸气)

(1)
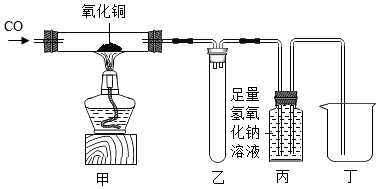
甲组同学称取一定质量的赤铁矿粉,采用如图的装置进行实验。
(2)
乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应(氧化铁与稀硫酸反应生成硫酸铁和水),(填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)
甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
①装置A中发生反应的化学方程式是。
②为充分吸收反应生成的CO2 , 装置B中应盛放的试剂是浓溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
【方法一】称量反应前后A装置的总质量,计算出Fe2O3的含量;
【方法二】称量得出反应生成的CO2的质量,计算出Fe2O3的含量。
方案 | 优 点 |
甲组 | |
乙组 |
【考点】
碳、一氧化碳、氢气还原氧化铜实验;