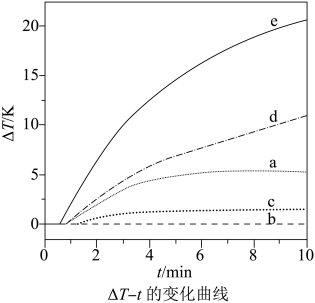
1.
化学小组实验探究 与
与 溶液的反应。
溶液的反应。
(1)
实验一:用如下装置(夹持、加热仪器略)制备 , 将足量
, 将足量 通入
通入 溶液中,迅速反应,得到无色溶液
溶液中,迅速反应,得到无色溶液 和白色沉淀
和白色沉淀 。
(2)
实验二:验证
。
(2)
实验二:验证 的成分
(3)
实验三:探究
的成分
(3)
实验三:探究 的产生途径
(4)
实验一中
的产生途径
(4)
实验一中 与
与 溶液反应的离子方程式是。
(5)
根据上述实验所得结论:在实验条件下,①碱性溶液中
溶液反应的离子方程式是。
(5)
根据上述实验所得结论:在实验条件下,①碱性溶液中 更易被氧化为
更易被氧化为 ;②。
;②。

浓与
反应的化学方程式是。
对体系中有关物质性质分析得出:沉淀可能为
、
或二者混合物。
(资料:;
;
;
;

①写出溶于氨水的离子方程式:。
②加入盐酸后沉淀大部分溶解,剩余少量沉淀
。推断
中一定含有。(填化学式)
根据沉淀的存在,推测
的产生有两个途径:
途径1:实验一中,在
溶液中被氧化生成
, 随沉淀
进入
。
途径2:实验二中,被氧化为
进入
。
①向溶液中滴入过量盐酸,产生白色沉淀,证明溶液中含有;取上层清液继续滴加
溶液,未出现白色沉淀,可判断
中不含
。做出判断的理由:。
②实验三的结论:。
根据物质性质分析,与
溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有
和
生成。
【考点】
难溶电解质的溶解平衡及沉淀转化的本质;