1.
依据电化学原理,回答下列问题:
(1)
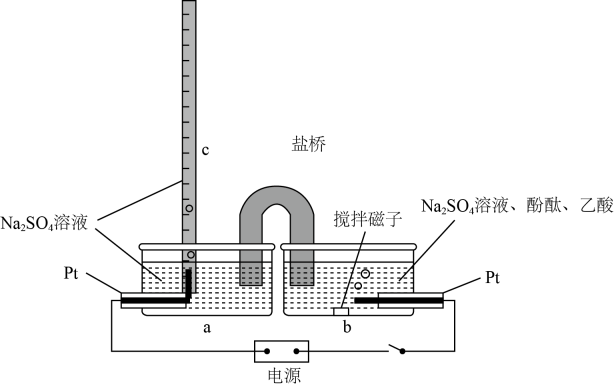
如图是依据氧化还原反应 设计的原电池装置。
(2)
甲醇(
设计的原电池装置。
(2)
甲醇( )和
)和 在下列装置中反应可以形成为原电池,其结构示意图如下:
(3)
用NaOH溶液吸收烟气中的
在下列装置中反应可以形成为原电池,其结构示意图如下:
(3)
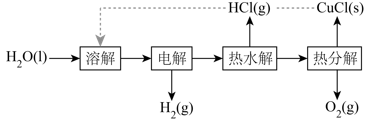
用NaOH溶液吸收烟气中的 , 将所得的
, 将所得的 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到 , 其原理如下图所示(电极材料为石墨)。
, 其原理如下图所示(电极材料为石墨)。

①Y上发生的电极反应式为。
②盐桥中装有含KCl饱和溶液的琼脂,放电过程盐桥中向左侧烧杯移动的离子主要是(填离子符号)。

电池总反应为 , 则a加入的是,电极d的电极反应式为。

①图中a极要连接电源的(填“正极”或“负极”),A口获得的物质是。
②放电的电极反应式为。
【考点】
电极反应和电池反应方程式;
能力提升
真题演练