1.
关于周期表中前四周期元素的单质及其化合物在诸多领域都有广泛的应用。请回答下列问题:
(1)
钠在火焰上灼烧的黄光是一种(填字母)。
(2)
22号元素Ti在周期表中的位置是,基态Ti原子最高能层电子的电子云轮廓形状为。与Ti同周期的过渡元素中,未成对电子数最多的的基态原子的外围电子的轨道表示式。
(3)
镍元素基态原子的电子排布式为;元素铜与镍的第二电离能分别为 、
、 ,
,  的原因是。
(4)
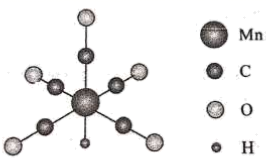
某配合物离子结构如右图所示,则该配离子中非金属元素的电负性大小顺序为。
的原因是。
(4)
某配合物离子结构如右图所示,则该配离子中非金属元素的电负性大小顺序为。
A.吸收光谱 B.发射光谱

【考点】
原子核外电子排布;
元素电离能、电负性的含义及应用;
能力提升
真题演练