1.
按要求回答下列问题:
(1)
基态Cl原子含有种空间运动状态不同的电子: 的VSEPR模型为。
(2)
下列铍元素的不同微粒,若再失去一个电子需要能量最大的是_____。
A.
的VSEPR模型为。
(2)
下列铍元素的不同微粒,若再失去一个电子需要能量最大的是_____。
A.
 B.
B.
 C.
C.
 D.
D.
 (3)
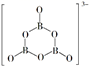
已知
(3)
已知 与
与 的结构如图,则
的结构如图,则 中的
中的
 中的
中的 (填“>”或“<”或“=”)。
(4)
X、Y、W三种物质(结构如图)在水中的溶解性由大到小的顺序为。
(5)
氮原子间能形成氮氮三键,而砷原子间不易形成三键的原因是。
(6)
(填“>”或“<”或“=”)。
(4)
X、Y、W三种物质(结构如图)在水中的溶解性由大到小的顺序为。
(5)
氮原子间能形成氮氮三键,而砷原子间不易形成三键的原因是。
(6)
 容易形成六配位的配合物,
容易形成六配位的配合物, 通常会水解生成棕色的
通常会水解生成棕色的 , 通过氢氧根形成双聚体
, 通过氢氧根形成双聚体 , 请写出该双聚体的结构(水分子中
, 请写出该双聚体的结构(水分子中 键省略,其他化学键用短横线“—”表示)。
(7)
早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:。
键省略,其他化学键用短横线“—”表示)。
(7)
早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:。
(8)
常温时为金刚石型结构如图,该结构中硅原子与 键的数量比为,下图中为晶胞(图1)对角面的投影图(以表示硅原子)的是。(填选项)
(9)
GaAs的晶胞结构如图甲。将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。
键的数量比为,下图中为晶胞(图1)对角面的投影图(以表示硅原子)的是。(填选项)
(9)
GaAs的晶胞结构如图甲。将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。
 C.
C.


物质 | ||||
熔点/℃ | 442 | 29 | 143 |

A. B.
B. C.
C.  D.
D.

①若晶体密度为
, 相对分子质量为
表示阿伏加德罗常数的数值,则晶胞中距离最近的两个Ga原子间距离为nm。
②掺杂Mn之后,晶体中的原子个数比为。
【考点】
元素电离能、电负性的含义及应用;
晶胞的计算;
氢键的存在对物质性质的影响;