1.
某小组设计实验探究某常见金属与硝酸反应。
实验(一)与浓硝酸反应。
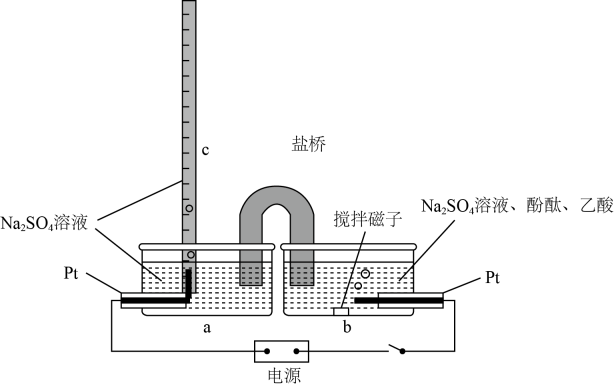
取金属片和铜片在浓硝酸中构成原电池,如图所示。
步骤 | 操作及现象 | 记录 |
① | 安装如图装置,加入试剂进行反应,电流表指针偏转 | 电流强度(Ⅰ)为 |
② | 随着反应进行,电流表指针偏转角度减小 |
|
③ | 电流表指针向反方向偏转 | 电流强度(Ⅰ)为 |

(1)步骤③中,负极的电极反应式为。
(2)符合实验现象的金属可以是(填一种金属的化学式即可)。
(3)若为铁,探究铁极表面的物质组成。实验完毕,用蒸馏水清洗铁电极后,将该铁电极浸泡于盐酸中一段时间,将得到的溶液分成甲、乙两份,进行如下实验:
实验 | 操作 | 现象 |
ⅰ | 向甲中滴加 | 无明显现象 |
ⅱ | 向乙中滴加 | 产生蓝色沉淀 |
已知遇
溶液会产生蓝色沉淀,则关于铁极表面物质的推断合理的是 (填字母)。
| A. 一定是 | B. 一定不含 | C. 一定是 | D. 可能是 |
实验(二)铁与极稀硝酸反应。
已知:(棕色)。

实验发现,装置中溶液变棕色,装置D中黑色粉末变为红色,装置E中白色粉末变为蓝色。实验完毕后,取少量装置
中溶液,加入浓
溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色。
(4)根据装置、
现象可知,装置A中还原产物有(填化学式),产生该气体的原因是。
(5)假设上述实验生成三种还原产物且物质的量之比为 ,
完全反应转移
电子。写出该反应的离子方程式:。
【考点】
电极反应和电池反应方程式;