1.
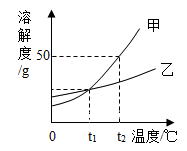
如图是KNO3和NaCl的溶解度曲线。下列说法中正确的是

A.
NaCl的溶解度不受温度的影响
B.
t1℃时,KNO3饱和溶液中溶质的质量分数是20%
C.
在温度低于t2℃范围内,KNO3的溶解度始终小于NaCl的溶解度
D.
t2℃时,NaCl饱和溶液与KNO3饱和溶液中,溶质的质量分数不一定相等
【考点】
固体溶解度曲线及其作用;
溶质的质量分数及相关计算;