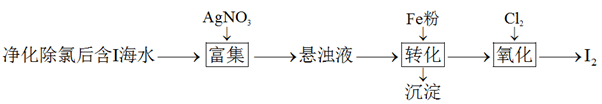
1.
 的排放,往往会产生污染。某研究性小组验证NO与炽热的铜粉会发生反应
的排放,往往会产生污染。某研究性小组验证NO与炽热的铜粉会发生反应 , 从而可减少NO的污染,方案设计如下:
, 从而可减少NO的污染,方案设计如下:

已知:NO能被酸性高锰酸钾溶液氧化成 , 此体系中产生的
浓度较稀。
(1)
装置C的名称,写出装置A中发生反应化学方程式为。
(2)
装置B中Cu单质的作用。
(3)
有关该实验,下列说法不正确的是。
(4)
B装置中也可加入稀硫酸,目的是;实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为。
(5)
有同学发现装置A溶液呈绿色,而不显蓝色;甲认为是该溶液中硝酸铜质量分数较高所致,而乙认为是该溶液溶解了生成的气体所致。设计方案来判断甲或乙哪种合理,下列方案中不可行的是______。
A.
适当加热该绿色溶液,观察颜色变化
B.
加水稀释绿色溶液,观察颜色变化
C.
向该绿色溶液中通入氮气,观察颜色变化
D.
向硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
A.实验开始前要通 , 实验结束后也要通
B.C装置中的可用无水
替代
C.F装置中的试剂是NaOH,吸收尾气,防止污染环境
【考点】
氧化还原反应方程式的配平;