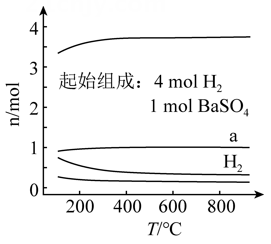
1.
氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。
(1)
硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理为
 kJ⋅mol
kJ⋅mol 。
(2)
化学反应一般都有反应热。1 mol气态
。
(2)
化学反应一般都有反应热。1 mol气态 与1 mol
与1 mol  反应生成2 mol气态HCl时,放出184.6 kJ热量。
反应生成2 mol气态HCl时,放出184.6 kJ热量。
①该反应的反应物的总能量(填“大于”或“小于”)生成物的总能量。
②该反应中,每断裂0.1 mol 键时,总反应(填“放出”或“吸收”)的热量为kJ。
③每产生33.795 kJ热量时,转移的电子数为。
①该反应的热化学方程式为。
②若1 mol气态与1mol
反应生成2 mol液态HCl,此时放出的热量(填“大于”或“小于”)184.6 kJ,判断的理由为。
【考点】
吸热反应和放热反应;
能力提升
真题演练