1.
氮是构建化合物的重要元素。请回答:
(1)
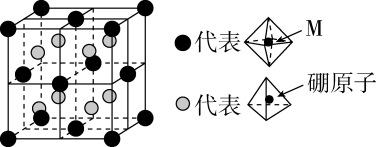
某种含B和N两种元素的功能陶瓷,其晶胞结构示意图如图所示。B的配位数为,写出功能陶瓷的化学式:。
(2)
下列说法正确的是___________。
A.
基态氮原子价电子排布图不是 , 是因为该排布方式违背了洪特规则
B.
, 是因为该排布方式违背了洪特规则
B.
 的空间结构为直线形
C.
第二周期元素的第一电离能比N大的只有1种
D.
已知液氨自耦电离产生
的空间结构为直线形
C.
第二周期元素的第一电离能比N大的只有1种
D.
已知液氨自耦电离产生 和
和 , 可推测
, 可推测 和
和 反应生成
反应生成 和
和 (3)
(3)
 与
与 可生成
可生成 配离子,已知
配离子,已知 与
与 结构相似,而
结构相似,而 不易与
不易与 形成配离子的原因是。
(4)
形成配离子的原因是。
(4)
 和
和 可以看成是
可以看成是 中一个H分别被
中一个H分别被 、―OH取代后的产物,都具有碱性和还原性。
、―OH取代后的产物,都具有碱性和还原性。

 , 是因为该排布方式违背了洪特规则
B.
, 是因为该排布方式违背了洪特规则
B.
①、
、
碱性由强到弱的顺序为。
②液态能将AgBr还原,试写出反应方程式:。
【考点】
晶胞的计算;
能力提升
真题演练