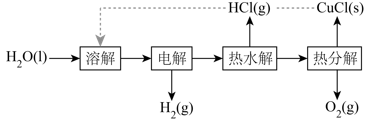
1.
回答下列问题:
(1)
下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。B极上的电极反应式;若用该燃料电池做电源,用石墨做电极电解100mL1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为L(标况下)。
(2)
下图是高能锂电池的工作原理,其总反应式为 , 装置中的
, 装置中的 和
和 为电解质。用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下
为电解质。用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下 。B电极为极,电源正极反应式为,从隔膜中通过的离子数目为,若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为mol/L。
。B电极为极,电源正极反应式为,从隔膜中通过的离子数目为,若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为mol/L。


【考点】
电极反应和电池反应方程式;
电解池工作原理及应用;
能力提升
真题演练