1.
某研究小组用氨基钠  与N2O反应制备叠氮化钠
与N2O反应制备叠氮化钠 并对制得的叠氮化钠产品纯度进行测定。已知氨基钠熔点为208℃,极易水解和氧化; N2O不与酸或碱反应;叠氮酸(HN3)不稳定,易分解爆炸;SnCl2具有较强还原性。回答下列问题:
并对制得的叠氮化钠产品纯度进行测定。已知氨基钠熔点为208℃,极易水解和氧化; N2O不与酸或碱反应;叠氮酸(HN3)不稳定,易分解爆炸;SnCl2具有较强还原性。回答下列问题:
(1)
制备叠氮化钠:连接好装置后,打开A中分液漏斗活塞,向圆底烧瓶中滴加浓硝酸,充分反应。
(2)
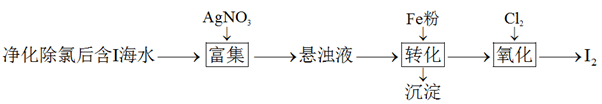
测定产品纯度:取装置C中制得的叠氮化钠样品m克放入圆底烧瓶中进行纯度的测定,如下图。

①装置D中盛装碱石灰的仪器名称为。
②装置的连接顺序为(填仪器接口字母)。
③若三颈烧瓶中参加反应的 和N2O物质的量之比为2∶1,则发生的化学反应方程式为,E装置的作用为。
④装置C充分反应后,停止加热,需继续通入N2O至三颈瓶冷却,再关闭分液漏斗活塞,这样操作的目的为。

①圆底烧瓶中反应的离子方程式为。
②读取气体体积时,应注意、使量气管与干燥管左右液面相平、视线与凹液面最低点水平相切。
③若量气管的初始读数为x mL、末读数为y mL,本实验条件下气体摩尔体积为Vm L/mol,则产品中NaN3的质量分数为。
【考点】
氧化还原反应方程式的配平;
能力提升
真题演练