1.
工业上以锂辉石为原料生产碳酸锂的部分工业流程如图所示:

已知:(1)锂辉石的主要成分为Li2O·Al2O3·4SiO2 , 其中含少量元素。
(2)Li2O·Al2O3·4SiO2+H2SO4(浓)Li2SO4+Al2O3·4SiO2·H2O
(3)某些物质的溶解度(S)如下表所示:
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
回答下列问题:
(1)
从滤渣1中分离出 的流程如图所示:
(2)
已知滤渣2的主要成分有。
(3)
最后一个步骤中,用“热水洗涤”的目的是。
(4)
工业上,将
的流程如图所示:
(2)
已知滤渣2的主要成分有。
(3)
最后一个步骤中,用“热水洗涤”的目的是。
(4)
工业上,将 粗品制备成高纯
粗品制备成高纯 的部分工艺如下:
(5)
磷酸亚铁锂电池总反应为FePO4+Li
的部分工艺如下:
(5)
磷酸亚铁锂电池总反应为FePO4+Li LiFePO4 , 电池中的固体电解质可传导
LiFePO4 , 电池中的固体电解质可传导 , 写出该电池放电时的正极反应:。
(6)
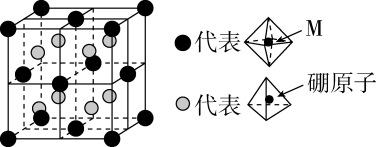
铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。Ca和Cr的最近距离为anm,设NA为阿伏加德罗常数的值,则该晶体密度为(填含a、NA的表达式)g·cm-3。
, 写出该电池放电时的正极反应:。
(6)
铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。Ca和Cr的最近距离为anm,设NA为阿伏加德罗常数的值,则该晶体密度为(填含a、NA的表达式)g·cm-3。
![]()
写出生成沉淀的离子方程式:。
a.将溶于盐酸作电解槽的阳极液,
溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
b.电解后向溶液中加入少量
溶液并共热,过滤、烘干得高纯
。
①a中电解时所用的是(填“阳离子交换膜”或“阴离子交换膜”)。
②电解后,溶液浓度增大的原因是,
中生成
反应的化学方程式是

【考点】
晶胞的计算;