1.
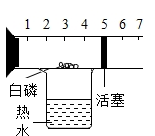
氧气在化学中有着举足轻重的地位,实验小组的同学用下图装置测定空气中氧气含量。

【实验改进】
改进一:点火方式改进。
(1)如图2所示,利用电热丝通电放出热量引燃红磷,其优点是(写一点)。
改进二:测量方式改进。
为了帮助同学们更好地理解空气中氧气含量测定的实验原理,老师用气压传感器测定了图1装置内的压强变化,其变化情况如图3所示。
(2)BC段压强增大,原因是。
(3)用木炭代替红磷完成此实验,集气瓶内气压变化趋势与图3(填“相同”或“不同”)。
改进三:反应原理的创新。
小明利用图4测定空气中氧气含量,已知发热剂的主要成分为铁粉、炭粉、水和食盐等,反应原理可简化为铁生锈消耗集气瓶中的氧气。
得数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
(4)根据表中数据计算得出空气中氧气的体积分数约为。
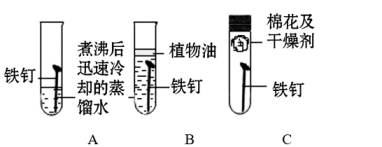
(5)小可改进了小明同学的实验,如图5,将同样足量的发热剂均匀涂抹在集气瓶内壁的四周,这样做的目的是。

【考点】
测定空气中的氧气含量;
金属锈蚀的条件及其防护;
基础巩固
能力提升
变式训练
拓展培优
真题演练



















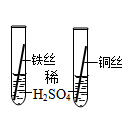
 将表面生锈的铁钉放入稀盐酸中
将表面生锈的铁钉放入稀盐酸中 红磷在密闭容器中燃烧
红磷在密闭容器中燃烧 向硫酸铜溶液中加入锌粉
向硫酸铜溶液中加入锌粉 向稀盐酸中滴加硝酸银溶液
向稀盐酸中滴加硝酸银溶液