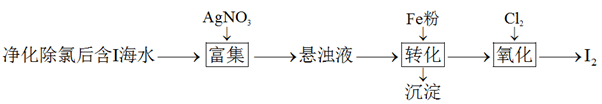
1.
某实验小组用如下实验装置模拟工业上制取硝酸:

(1)
控制氧气的流速是制硝酸的关键,该实验可通过来判断氧气的流速。
(2)
由于水的比热容较大, 中挥发的水蒸气会影响
中挥发的水蒸气会影响 中的反应温度,所以应在
中的反应温度,所以应在 之间插入装有(填字母)的干燥装置。
(3)
写出装置B中发生反应的化学方程式:。
(4)
实验时观察到装置D中出现红棕色气体,其原因是(用化学方程式表示)。
(5)
工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁,然后在较低温度下进行蒸馏,蒸馏时不能采用较高温度的原因是。
(6)
工业生产中为了盛装大量浓硝酸,可选择(填字母)作为罐体材料。
(7)
工业上可以以废铜屑为原料制备硝酸铜,请从节约原料和环境保护的角度从以下4种方法中选出最适宜采用的方法(填序号)。
之间插入装有(填字母)的干燥装置。
(3)
写出装置B中发生反应的化学方程式:。
(4)
实验时观察到装置D中出现红棕色气体,其原因是(用化学方程式表示)。
(5)
工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁,然后在较低温度下进行蒸馏,蒸馏时不能采用较高温度的原因是。
(6)
工业生产中为了盛装大量浓硝酸,可选择(填字母)作为罐体材料。
(7)
工业上可以以废铜屑为原料制备硝酸铜,请从节约原料和环境保护的角度从以下4种方法中选出最适宜采用的方法(填序号)。
a.浓 b.碱石灰 c.无水
a.铁 b.铂 c.铝 d.镁
①
②
③
④
【考点】
氧化还原反应方程式的配平;
能力提升
真题演练