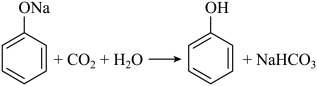
1.
 溶液常被用作蚀刻剂腐蚀印刷电路板:
溶液常被用作蚀刻剂腐蚀印刷电路板: , 在过量
, 在过量 溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生、两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是。
溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生、两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是。
【考点】
离子方程式的书写;
能力提升
变式训练
拓展培优
真题演练