1.
高效氧化剂亚氯酸钠( )常用于烟气脱硝(
)常用于烟气脱硝( )和废水脱除氨氮。
)和废水脱除氨氮。
(1)
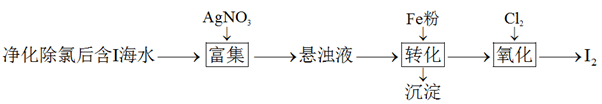
 的制备。一种制备
的制备。一种制备 的过程可表示为
(2)
的过程可表示为
(2)
 溶液对烟气脱硝。
(3)
溶液对烟气脱硝。
(3)
 溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的
溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的 溶液,用传感器测得溶液中
溶液,用传感器测得溶液中 与
与 含量随反应时间的变化如图所示。判断该实验中被氧化的
含量随反应时间的变化如图所示。判断该实验中被氧化的 是否全部转化为
是否全部转化为 的依据为。
的依据为。

①“反应2”的化学方程式为。
②“反应1”的产物经净化后常作为饮用水消毒剂替代传统的
, 从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用
替代
的原因是。
①酸性条件下,可催化溶液中的
产生氧化性更强的
气体,总反应可表示为
。请补充完整过程Ⅱ的离子方程式:
I.;
Ⅱ.;
Ⅲ.。
②催化
溶液脱硝。其他条件相同时,烟气中NO氧化率随
、反应温度的变化分别如图所示。

i.NO氧化率随增大而增大的原因是。
ii.温度升高,NO氧化率先增大后减小的可能原因是。

【考点】
氧化还原反应方程式的配平;
能力提升
真题演练