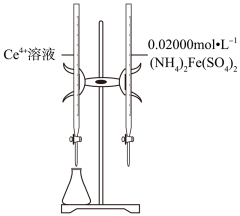
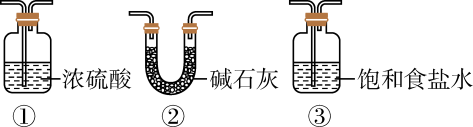
1.
铼是重要的战略金属,实验室以二硫化铼( )为原料用图1装置制备高铼酸铵(
)为原料用图1装置制备高铼酸铵( ),进一步在高温下用氢气还原高铼酸铵制备金属铼。
),进一步在高温下用氢气还原高铼酸铵制备金属铼。

已知:①在水中易被
,
、
等氧化为高铼酸和硫酸;
②高铼酸是强酸,可用有机物TBP(磷酸二丁酯)萃取,室温下,在两相间的分配系数
, 萃取率
;
③相关化合物的溶解度和温度的关系如图2所示。

(1)
气密性检验后,打开 , C中反应的离子方程式为,一段时间后再打开
, C中反应的离子方程式为,一段时间后再打开 , 若C中压强过大,可观察到的现象是,装置D中的药品是氯化钙,其作用为。
(2)
反应结束后,取三颈烧瓶中液体进行下列操作:
(3)
所得产品仍含有未反应的高铼酸铵(摩尔质量为M g⋅mol
, 若C中压强过大,可观察到的现象是,装置D中的药品是氯化钙,其作用为。
(2)
反应结束后,取三颈烧瓶中液体进行下列操作:
(3)
所得产品仍含有未反应的高铼酸铵(摩尔质量为M g⋅mol ),用下列方法测定产品中金属铼的含量。取产品m g,加入热水溶解,过滤,向所得滤液中加足量浓氢氧化钠溶液并加热,产生的氨气用硼酸吸收,吸收液用盐酸标准液滴定,消耗c mol⋅L
),用下列方法测定产品中金属铼的含量。取产品m g,加入热水溶解,过滤,向所得滤液中加足量浓氢氧化钠溶液并加热,产生的氨气用硼酸吸收,吸收液用盐酸标准液滴定,消耗c mol⋅L 盐酸V mL(已知:
盐酸V mL(已知: ;
; )。则金属铼的质量分数为(用含M、m、c、V的表达式表示)。下列情况会造成金属铼的质量分数偏小的是(填字母)。
(4)
低浓度高铼酸溶液可通过萃取、反萃取得到高浓度的
)。则金属铼的质量分数为(用含M、m、c、V的表达式表示)。下列情况会造成金属铼的质量分数偏小的是(填字母)。
(4)
低浓度高铼酸溶液可通过萃取、反萃取得到高浓度的 。室温时,向15 mL高铼酸溶液中加入5 mL TBP充分振荡静置分层,
。室温时,向15 mL高铼酸溶液中加入5 mL TBP充分振荡静置分层, 在水层的浓度为
在水层的浓度为 mol⋅L
mol⋅L , TBP的萃取率为(保留三位有效数字)。
, TBP的萃取率为(保留三位有效数字)。
ⅰ.…;
ⅱ.将所得固体置于硬质玻璃管中,点燃酒精喷灯;
ⅲ.向硬质玻璃管中通入;
ⅳ.一段时间后停止加热,冷却后停止通入。
操作ⅰ为,上面操作的合理顺序为。
a.加入冷水溶解产品
b.产生的氨气未被充分吸收
c.滴定达终点,读数结束后发现滴定管尖嘴悬挂液滴
d.酸式滴定管未用标准液润洗
【考点】
探究物质的组成或测量物质的含量;
制备实验方案的设计;
能力提升
真题演练