1.
如图为我国古代“布灰种盐”生产海盐的部分场景,其过程为“烧草为灰,布在滩场,然后以海水渍之,侯晒结浮白,扫而复淋。”
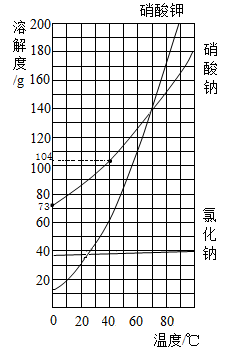
温度℃ | 20 | 60 | 90 | 100 | |
溶解度/g | NaCl | 36.0 | 37.3 | 39.0 | 39.8 |
54.8 | 61.3 | 70.0 | 73.0 | ||
33.5 | 52.2 | 51.1 | 46.2 | ||

(1)
“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,该过程和化学实验操作的原理相似。(填“蒸发结晶”“降温结晶”)
(2)
经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”,将“上等卤水”在100℃恒温蒸发至有晶体析出,过滤,所得溶液的质量为150g,其中溶液中含水100g、NaCl39.8g、 7.65g及
7.65g及 2.55g(其他成分忽略不计),再将此溶液降温至20℃,所得溶液为NaCl的(填“饱和”或“不饱和”)溶液,此时溶液中
2.55g(其他成分忽略不计),再将此溶液降温至20℃,所得溶液为NaCl的(填“饱和”或“不饱和”)溶液,此时溶液中 的质量分数为(结果精确至0.1%)。
(3)
下列有关说法中正确的是______。
A.
60℃时,
的质量分数为(结果精确至0.1%)。
(3)
下列有关说法中正确的是______。
A.
60℃时, 溶液的溶质质量分数小于
溶液的溶质质量分数小于 溶液的
B.
将60℃时NaCl和
溶液的
B.
将60℃时NaCl和 的饱和溶液降温至20℃,
的饱和溶液降温至20℃, 溶液中析出的晶体更多
C.
90℃时,将20g NaCl加入50g水中充分溶解,可得到69.5g NaCl溶液
D.
90℃时,将等质量的
溶液中析出的晶体更多
C.
90℃时,将20g NaCl加入50g水中充分溶解,可得到69.5g NaCl溶液
D.
90℃时,将等质量的 、NaCl饱和溶液降温至20℃,
、NaCl饱和溶液降温至20℃, 溶液中水的质量更大
溶液中水的质量更大
【考点】
结晶的原理、方法及其应用;
饱和溶液和不饱和溶液;
固体溶解度曲线及其作用;
溶质的质量分数及相关计算;